lunes, 16 de junio de 2008
martes, 3 de junio de 2008
viernes, 30 de mayo de 2008
Problemas en los que intervienen reacciones químicas
En la siguiente presentación se resuelve un problema aplicando este procedimiento.
Reacciones químicas en disolución
Aunque existen distintos tipos de disoluciones, vamos a trabajar con disoluciones formadas por una especie química (soluto) disuelta en agua (disolvente).
Para expresar la concentración de una disolución vamos a utilizar la molaridad, es decir, los moles de soluto disueltos en cada litro de disolución:
jueves, 29 de mayo de 2008
Ecuaciones químicas
Las reacciones químicas se representan simbólicamente mediante las ecuaciones químicas. Escribimos a la izquierda de la flecha las especies químicas que reaccionan (reactivos) y a la derecha las especies químicas que se forman durante la reacción (productos).
Las ecuaciones químicas tienen que estar ajustadas para poder relacionar el número de moles (o el de átomos y moléculas) de los reactivos y de los productos. Para ajustar una ecuación se colocan los números convenientes delante de las especies que reaccionan y se forman, para que se cumpla la ley de conservación de la masa, es decir, para que el número de átomos de cada elemento sea el mismo a la izquierda y a la derecha de la flecha. Veamos un ejemplo.
Podéis prácticar en los siguientes enlaces:
Ajuste de una ecuación química
Ecuaciones químicas para ajustar
Principio de Avogadro
miércoles, 28 de mayo de 2008
Ley de los volumenes de combinación
En una reacción química, los volumenes de las sustancias gaseosas que intervienen guardan entre sí una proporción de números enteros y sencillos, si se miden en las mismas condiciones de presión y temperatura.
Esa proporción coincide con la proporción en el número de moléculas de las sustancias gaseosas que reaccionan y que se forman durante el proceso.
1 moléculas 2 molécula 2 moléculas
1 L 2 L 2 L

Ley de las proporciones definidas
Cuando dos o más elementos se combinan para formar el mismo compuesto, lo hacen siempre en proporciones de masa definidas y constantes.
Por ejemplo, siempre que el oxígeno y el hidrógeno se combinen para formar agua la relación entre sus masas es: masa oxígeno/masa hidrógeno=8.
De lo anterior se deduce que la composición de una sustancia pura es siempre la misma, independientemente del modo en que se haya preparado o de su lugar de procedencia.
Esta ley es otro de los argumentos que utilizó Dalton para suponer que la materia está constituida por átomos, y que estos se unen entre sí en una proporción sencilla 1:1,1:2,1:3, etc, para formar compuestos.

domingo, 25 de mayo de 2008
Ley de conservación de la masa
sábado, 24 de mayo de 2008
Cantidad de sustancia. El mol y la masa molar
2 moléculas 1 molécula 2 moléculas
2 x 2 umas 32 umas 2 x 18 umas
Pero en el laboratorio no se puede trabajar con átomos o moléculas, porque no se pueden observar y, por tanto, no se pueden contar. Necesitamos cantidades de estas sustancias que podamos manipular y en la que los átomos y las moléculas se encuentren en la misma proporción que a nivel molecular.
Como cada molécula de O2 tiene 16 veces más masa que una molécula de H2, masas de O2 y de H2 que se encuentren en la proporción de 16 a 1, contendrán el mismo número de moléculas.
En 32 g de O2 y en 2 g de H2 hay 6,022.1023 moléculas.
Para poder contar partículas (átomos, moléculas, iones, etc) se define una nueva magnitud física que es diferente de la masa, denominada cantidad de sustancia, cuya unidad es el mol.
Un mol es la cantidad de sustancia que contiene 6,022.1023 partículas de esa sustancia. A este número se le llama Número de Avogadro (NA).
La masa que se corresponde con esta cantidad de sustancia se llama masa molar y es la masa atómica o molecular de la sustancia expresada en gramos.
1 mol de H2 es la cantidad de H2 que contiene 6,022.1023 moléculas de H2. Su masa es 2 g.
1 mol de O2 es la cantidad de O2 que contiene 6,022.1023 moléculas de O2. Su masa es 18 g.
2xNA moléculas NA molécula 2xNA moléculas
2 mol 1 mol 2 mol
4 g 32 g 36 g
Podemos asegurar que en 4 g de H2 y en 36 g de H2O hay el doble de moléculas que en 32 g de O2.
lunes, 19 de mayo de 2008
La reacción química

En esta animación podemos observar como se produce la descomposición del óxido de mercurio a escala atómica.
sábado, 10 de mayo de 2008
Ejercicios para entregar del tema 8
Repaso de formulación
jueves, 8 de mayo de 2008
Los átomos son muy pequeños
• Supongamos que pudiéramos marcar las moléculas de un vaso de agua; vertamos entonces el contenido del vaso en el océano y agitemos de forma que las moléculas marcadas se distribuyan uniformemente por los siete mares; si después llenamos un vaso de agua en cualquier parte del océano, encontraremos en él alrededor de un centenar de moléculas marcadas. Lord Kelvin.
• Cualquier persona que haya vivido del orden de 65 años. Imaginad que todos los átomos que hubiera exhalado esa persona a lo largo de su vida se hubieran distribuido por igual por toda la atmósfera. Pues bien, cada vez que tomamos aire, cada uno de nosotros inhalaría aproximadamente unos 50 millones de moléculas de aire de estas. Así que puedes estar orgulloso, porque entre esos átomos se encuentran los respirados por Leonardo da Vinci o Albert Einstein, por ejemplo.
• Cada uno de los átomos que poseemos casi seguro que ha pasado por varias estrellas (de ahí la frase de Sagan que "somos polvo de estrellas") y ha formado parte de millones de organismos. Los átomos, en principio, viven para siempre (si a eso se le puede llamar vivir). Al morir, nuestros átomos se redistribuyen por todo el mundo así que no debería sorprenderte, después de las curiosidades dichas anteriormente, que más de 1000 millones de átomos que nos componen pertenecieran en otro momento a Arquímedes, Newton, Galileo o cualquier personaje histórico que conozcas.
Fuente: http://historias-de-la-ciencia.bloc.cat/post/1052/85134
viernes, 2 de mayo de 2008
Enlace metálico
* Son ductiles y maleables. Es decir, se pueden estirar en forma de hilos y extender en forma de láminas.
* Presentan brillo metálico.
* Conducen la corriente eléctrica y el calor.
Propiedades de los compuestos con enlace covalente
Hay dos tipos de susutancias diferentes que presentan enlaces covalentes: las sustancias moleculares y los cristales covalentes.
En los cristales covalentes se forman redes tridimensionales (cristales) en las que los átomos se unen entre sí por enlaces covalentes.
El enlace covalente es muy fuerte y, por tanto, difícil de romper; esto hace que los cristales covalentes presenten las siguientes propiedades:
* Presentan elevados puntos de fusión
* Muy poco solubles en cualquier tipo de disolvente.
* Suelen ser duros.
* Suelen ser malos conductores de la electricidad.
Son sustancias de este tipo el diamante, SiO2 (cuarzo), carburo de silicio (Si2C), nitruro de boro (BN), etc.

Las sustancias moleculares se caracterizan porque un número definido de átomos se unen mediante enlaces covalentes formando MOLÉCULAS. Como el enlace covalente es muy fuerte, se necesita una energía muy grande para poder romper las moléculas. En cambio, las moleculas se unen entre sí por fuerzas intermoleculares que son fuerzas débiles. Estas fuerzas intermoleculares son las responsables de la mayoría de las propiedades de estas sustancias:
* Se pueden presentar en estado sólido, líquido o gaseoso a temperatura ambiente.
*En general, sus puntos de fusión y ebullición no son elevados, aunque serán mayores cuando las fuerzas intermoleculares que unen a las moléculas sean más intensas.
* Suelen ser blandas, pues al rayarlas se rompen las fuerzas intermoleculares.
* La solubilidad es variable.
* En general, son malos conductores de la electricidad.
Son muchas las sustancias de este tipo: H2, Br2, H2O, NH3, compuestos orgánicos, etc.
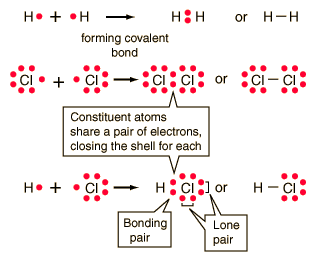
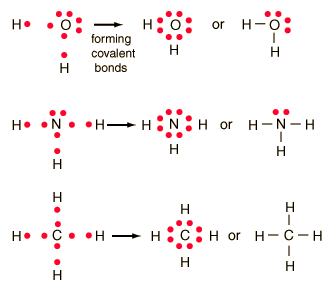
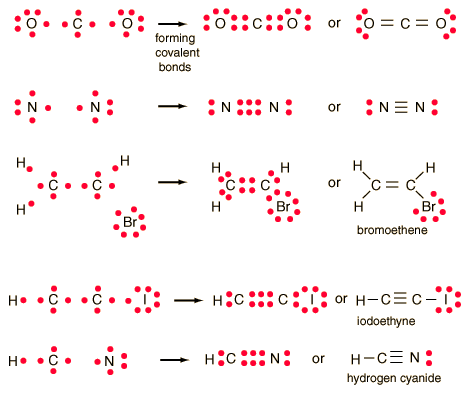
Enlace covalente
Propiedades de los compuestos iónicos
- Son duros, ya que el enlace iónico es un enlace fuerte.
- Son frágiles, pues si se aplica una fuerza sobre ellos se deslocaliza la estructura cristalina.
- Son solubles en agua.
- Conducen la corriente eléctrica disueltos y fundidos, debido a la movilidad que presentan los iones.
jueves, 1 de mayo de 2008
Enlace iónico
 En el enlace iónico se produce una transferencia de electrones desde los átomos de un metal (que tienen tendencia a perder electrones) a los átomos de un no metal (que tienen tendencia a ganarlos), formándose iones positivos y negativos. Las interacciones eléctricas entre los iones hacen que se distribuyan de manera ordenada en las tres direcciones del espacio originando un red cristalina (un cristal).
En el enlace iónico se produce una transferencia de electrones desde los átomos de un metal (que tienen tendencia a perder electrones) a los átomos de un no metal (que tienen tendencia a ganarlos), formándose iones positivos y negativos. Las interacciones eléctricas entre los iones hacen que se distribuyan de manera ordenada en las tres direcciones del espacio originando un red cristalina (un cristal).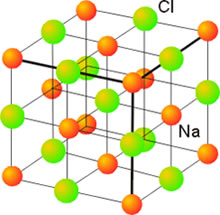
Enlace químico
Vamos a estudiar tres tipos de enlaces entre átomos: el enlace iónico, el enlace covalente y el enlace metálico.

martes, 29 de abril de 2008
Regularidades en las propiedades de los elementos del sistema periódico

A los elementos de la izquierda de la tabla los llamamos METALES y tienden a perder electrones para adquirir la configuración electrónica del gas noble más cercano, que es el que se encuentra en el periódo anterior.
A los elementos que se encuentran a la derecha los llamamos NO METALES y tienden a captar electrones para adquirir la configuración electrónica del gas noble de su período.
Los elementos de un mismo GRUPO tienen la misma configuración electrónica en el último nivel de energía, lo que hace que presenten propiedades químicas similares. Por ejemplo, todos los elementos alcalinos reaccionan con el agua desprendiendo calor ,aunque la reacción es más violenta a medida que descendemos en el grupo, ya que las propiedades metálicas se acentúan; cuando se combinan con el hidrógeno o con el oxígeno lo hacen en la misma proporción (LiH, NaH, KH, RbH, CsH); etc.
A lo largo de un PERÍODO las propiedades químicas y físicas varían regularmente.
lunes, 28 de abril de 2008
miércoles, 23 de abril de 2008
Tabla periódica de los elementos
Tabla periódica 1
tabla periodica 2
Tabla periódica 3
Clasificación periódica de Mendeleiev
Alteró el orden de las masas atómicas para situar elementos al lado de otros a los que se parecían (Te y I). Cuando las propiedades de un elemento no se correspondían con su posición, dejó huecos que más tarde fueron ocupados por elementos que no se conocían en su época (Ga y Ge).


Número atómico, número másico y masa atómica
El número másico es la suma del número de protones y de neutrones de un átomo. Los átomos de un mismo elemento que se diferencia en el número de neutrones se llaman isótopos.
Para representar un átomo se escribe delante de su símbolo el número atómico como subindice y el número másico como superindice.

Como el gramo es una unidad demasiado grande para medir la masa de los átomos, se estableció como unidad de masa atómica (uma)
la doceava parte de la masa de un átomo de C- 12 ( 6 protones, 6 neutrones, 6 electrones).
Por ejemplo, la masa de un átomo de O-16 es 16 uma, porque su masa es 16 veces mayor que la doceava parte de la masa de un átomo de C-12.
La masa atómica de un elemento es el promedio de la masa de los distintos isótopos de ese elemento, teniendo en cuenta la abundancia relativa de los mismos.
En el siguiente enlace puedes jugar a construir átomos.
lunes, 21 de abril de 2008
Estructura electrónica
 Llamamos estructura electrónica o configuración electrónica a la distribución de los electrones de un átomo en los distintos subniveles.
Llamamos estructura electrónica o configuración electrónica a la distribución de los electrones de un átomo en los distintos subniveles.
El modelo atómico actual
En el primer subnivel (s) sólo hay un orbital; en el segundo subnivel (p) hay tres orbitales; en el tercer subnivel (d) hay cinco orbitales y en el cuarto subnivel (f) hay siete orbitales.
En cada orbital puede haber como máximo dos electrones.
Los orbitales atómicos tienen distintas formas geométricas.

El modelo de Bohr fue completado por Sommerfeld

domingo, 20 de abril de 2008
Modelo atómico de Bohr
- Cuando los electrones giran alrededor del núcleo atómico no emiten energía.
- Los electrones no pueden girar alrededor del núcleo a cualquier distancia, sólo lo pueden hacer en aquellas órbitas donde su energía tiene unos valores determinados. Es decir, los electrones se distribuyen alrededor del núcleo en distintos niveles de energía(n=1, n=2, n=3, n=4, ....)

- Para que un electrón salte de una órbita más cercana al núcleo, donde su energía vale Ei, a otra más alejada, donde su energía vale Ef, debe absorber una cantidad de energía igual a Ef-Ei. Esto explica la formación de las líneas del espectro de absorción; las líneas oscuras se corresponden con las radiaciones absorbidas por los electrones para poder saltar a órbitas más alejadas.
Si el electrón pasa de una órbita a otra más cercana al núcleo, emite una onda electromagnética cuya energía es igual a la perdida de energía del electrón al realizar el salto.
martes, 15 de abril de 2008
Espectros atómicos de emisión y de absorción
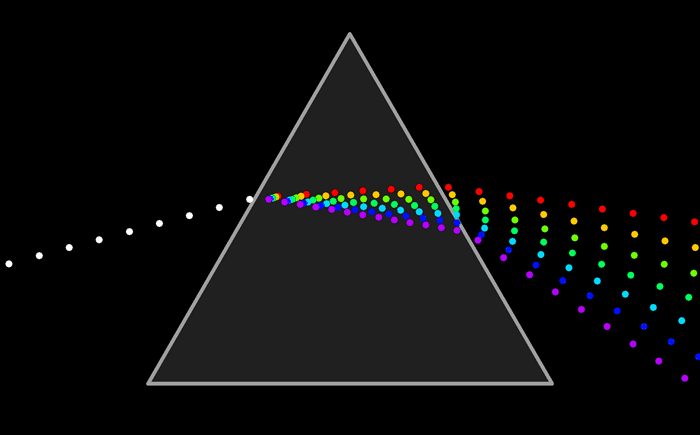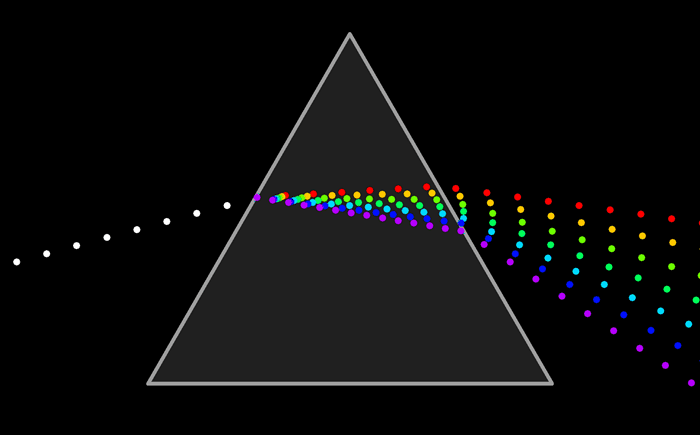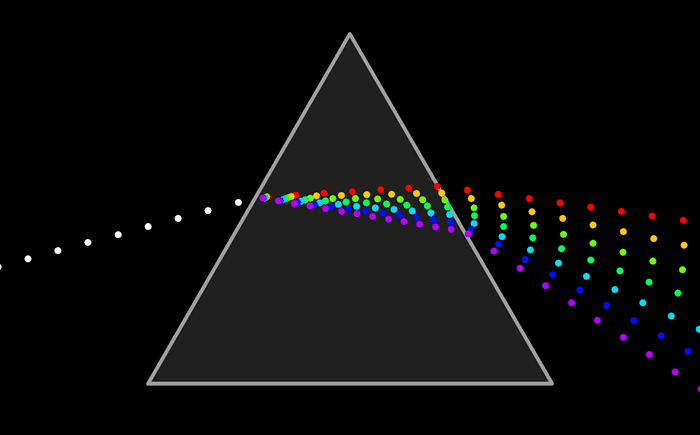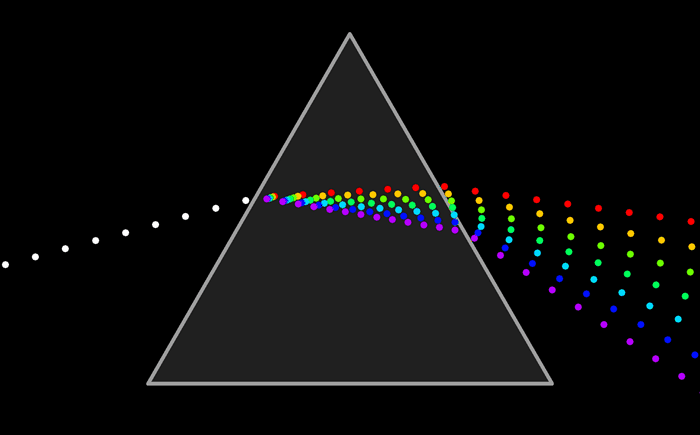
El modelo atómico de Ruterford no podía explicar el espectro de emisión de los elementos químicos; es decir, el conjunto de líneas que se obtienen al descomponer la radiación electromagnéticas emitida por un elemento químico que ha sido excitado previamente, ya sea mediante calor o mediante corriente eléctrica.
De la misma manera se puede analizar la luz que absorbe un elemento químico y conocer su espectro de absorción. El espectro de emisión y de absorción son característicos de cada elemento.
Modelo atómico de Rutherford
Experimento de Rutherford 2

Para poder explicar los resultados de su experimento, Rutherford estableció un modelo atómico en el que suponía que casi toda la masa del átomo y su carga positiva se concentraba en una pequeña región en el centro del átomo a la que llamó núcleo, y que los electrones giraban a gran distancia alrededor de este, describiendo órbitas circulares.

lunes, 14 de abril de 2008
miércoles, 9 de abril de 2008
Transmisión de la energía térmica
martes, 8 de abril de 2008
Transformación de energía mecánica en energía térmica
En cambio, mediante una máquina térmica (el motor de un coche, por ejemplo) sólo es posible transformar en energía mecánica una parte de la energía térmica disponible.
La energía térmica es, por tanto, menos útil que la energía mecánica para realizar un trabajo. La energía mecánica que se transforma en energía térmica no puede convertirse de nuevo totalmente en energía mecánica, por lo que decimos que la energía se degrada. Pierde calidad para realizar trabajo.
Dilatación anómala del agua

Funcionamiento del termostato bimetálico

Otros efectos del calor sobre los cuerpos

jueves, 13 de marzo de 2008
Calor latente de cambio de estado
martes, 11 de marzo de 2008
Calculo del calor específico de un metal
domingo, 9 de marzo de 2008
El termómetro de Galileo

El funcionamiento del termómetro de Galileo está basado en la variación de la densidad de un líquido con la temperatura y, por tanto, en la variación del Empuje de Arquímedes (E=d.g.V) que experimenta una esfera situada en el seno del líquido con la temperatura.
sábado, 8 de marzo de 2008
¿Cuántas julios equivalen a una caloria?
En el libro de texto hemos visto que el calor específico del agua es 4180 J/kg.ºC y en el video de la entrada anterior dicen que el calor específico del agua es 1 cal/gr.ºC. ¿Cuál será entonces la equivalencia entre el julio y la caloría?. Respuestas en COMENTARIOS.
Cantidad de calor transferida entre dos cuerpos a distinta temperatura
- la variación de temperatura depende de la masa del cuerpo.
- La variación de temperatura depende de la sustancia.
- La cantidad de calor transferida es proporcional a la variación de temperatura.
Estos hechos experimentales se pueden expresar cuantitativamente así:
Q = m . c . (tf-ti) donde Q es el calor suministrado en julios; m, la masa en kilogramos y tf y ti la temperatura final e inicial en ºC o K, y "c" es el calor específico que depende de la naturaleza del cuerpo.
jueves, 6 de marzo de 2008
Diferencia entre calor y temperatura
La TEMPERATURA es la energía cinética media de las partículas que forman un cuerpo y, por tanto, su valor no depende de la masa del cuerpo. Tiene la misma temperatura el agua de una piscina que el agua de la piscina que recogemos en un vaso.
Equilibrio térmico y escalas de temperatura
El funcionamiento de los termómetros se basa en el equilibrio térmico.
Entra en la siguiente página y pincha en PROPIEDADES y después en TEMPERATURA. En ella se explican las tres escalas que se usan para medir temperaturas. En la animación puedes medir la temperatura de fusión y ebullición del agua en las tres escalas.
¿Qué es la temperatura?
Energía térmica
domingo, 2 de marzo de 2008
Preguntas de teoría del próximo examen
Las cuestiones teóricas estarán relacionadas con los conceptos que se han desarrollado a lo largo del tema. Tendréis que tener claro qué es el TRABAJO MECÁNICO, LA POTENCIA, LA ENERGÍA, LA ENERGÍA CINÉTICA, LA ENERGÍA POTENCIAL, EL PRINCIPIO DE CONSERVACIÓN DE LA ENERGÍA MECÁNICA Y EL PRINCIPIO DE CONSERVACIÓN DE LA ENERGÍA.
jueves, 28 de febrero de 2008
Ejercicios para entregar RESUELTOS
sábado, 23 de febrero de 2008
jueves, 21 de febrero de 2008
Otro ejemplo de conservación de la E. mecánica
Las fuerzas conservativas son aquellas que tienen la propiedad de devolver el trabajo que se realiza para vencerlas.
martes, 19 de febrero de 2008
jueves, 14 de febrero de 2008
¿Qué me cuesta mi cacharro electrónico preferido al mes?
miércoles, 13 de febrero de 2008
Trabajo realizado por una fuerza
martes, 12 de febrero de 2008
Notas del control del tema 4
lunes, 11 de febrero de 2008
¿Cuál será tu nota del último examen?
Ejercicios para entregar semiresueltos
Examen del tema 4
lunes, 4 de febrero de 2008
Examen de mañana
domingo, 3 de febrero de 2008
Medir con un calibre
sábado, 2 de febrero de 2008
Qué os puedo preguntar de Teoría en el próximo examen
- Velocidad lineal y velocidad angular.
- Relación entre velocidad lineal y angular.
- Frecuencia y período.
- Fuerza centrípeta.
- Modelo del Universo de Ptolomeo.
- Modelo del Universo de Copérnico.
- Ley de Gravitación Universal.
- Por qué se producen las mareas.
- Modelo del Big Bang.
martes, 29 de enero de 2008
martes, 22 de enero de 2008
Empuje y Principio de Arquímedes
domingo, 20 de enero de 2008
sábado, 19 de enero de 2008
martes, 15 de enero de 2008
Estados de agregación de la materia
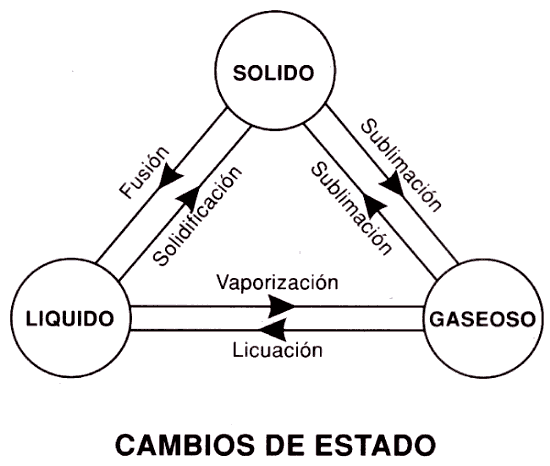
En este enlace podéis repasar los estados de agregación de la materia, la teoría cinética y los cambios de estado, que estudiasteis en 3º de ESO.